科学と文化のいまがわかる
医療
アルツハイマー病との闘い120年史
2023.05.26
認知症を引き起こすアルツハイマー病。
この病気が初めて報告されてからおよそ120年。
長年、根本的な治療法のない「不治の病」とされてきました。
しかし、新たな薬の登場で、その常識が変わるかもしれません。
(この特集記事の内容は、2023年5月28日午後11時30分の「サイエンスZERO」で放送されます。放送終了後から6月5日午前0時までNHKプラスの「見逃し配信」でご覧頂けます。)
開かれた新たな治療法の扉

東京大学 岩坪威 教授
「アルツハイマー病患者とその家族、そして、この分野のすべての科学者にとって、記念すべき出来事です」
2022年11月にアメリカで開かれたアルツハイマー病の国際的な学会で、1つの薬についての報告が世界的な注目を集めました。
その薬とは「レカネマブ」。
日本の製薬会社「エーザイ」などが開発したアルツハイマー病の新薬です。
認知症は、2025年には国内の65歳以上の5人に1人が認知症になると推計されています。
認知症はさまざまな病気が原因で起こりますが、最も多い6割から7割がアルツハイマー病だと考えられています。
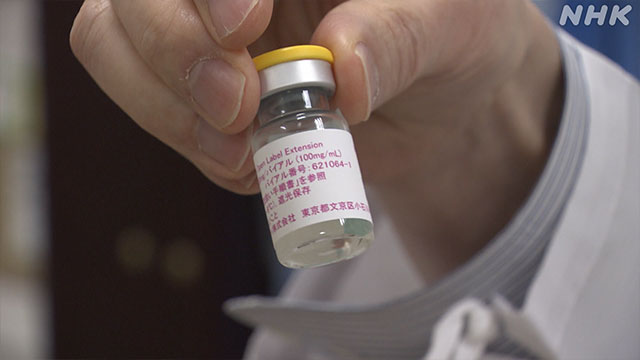
「レカネマブ」は、このアルツハイマー病の原因物質に直接働きかけて、症状の進行を抑えることができる薬だと発表されたのです。
これが本当なら、「根本治療」へ新たな扉が開かれた瞬間となるかもしれません。
2023年5月現在、この薬はアメリカではすでに「条件付きの承認」を受けていて、日本でも承認するかどうかの審査が進められています。
まだ国内では承認されてはいませんが、ここにたどり着くまで研究者と病気の長く厳しい闘いがありました。
最初のアルツハイマー病患者
アルツハイマー病が初めて報告されたのは、およそ120年前の1906年のことでした。
ドイツの医師、アロイス・アルツハイマー博士が、51歳で亡くなった「アウグステ・D」という女性の症例を学会で発表したのです。
女性には、これまで知られていなかった重い記憶障害がありました。

アルツハイマー博士は、女性の死後、脳を詳しく調べました。
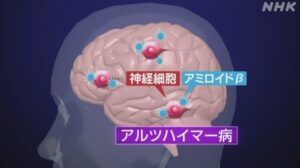
すると、脳の神経細胞の外に、通常は見られない奇妙なシミのような斑点があることに気づきます。
このシミは「老人班(senile plaque)」と名付けられ、アルツハイマー病の患者の脳に見られる特徴として知られるようになりました。
このシミはアルツハイマー病に深く関わっているはずです。
ただ、病気の原因なのか、それとも別の原因によってこのシミができているのか、その正体は長年にわたって謎となってきました。
老人班の正体は?
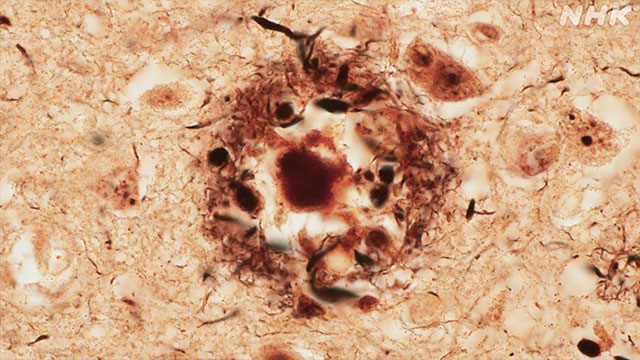
その後の研究で、1つ分かったことがありました。
このシミはある特殊なたんぱく質のかたまりだったのです。
その名は「アミロイドβ」。
このたんぱく質は、すべての人の脳の中で作られています。
ところが、何らかの原因でこれが集まって固まったものがあのシミだったのです。
高速原子間力顕微鏡で撮影した「アミロイドβ」 動画提供:金沢大学 小野賢二郎 教授
特殊な顕微鏡を使うと、「アミロイドβ」が集まって、繊維状に成長していく様子を観察することができます。
ただ、「アミロイドβ」のかたまりができることと、アルツハイマー病がどんな関係なのかは依然として謎のままでした。
アルツハイマー病の原因解明に糸口が
その謎に、解明の糸口が現れたのは1990年代のことです。
アルツハイマー病は、誰もがかかるおそれのある病気です。
しかし、世界各地で、アルツハイマー病を発症する人の割合が非常に多い家系の存在は知られていました。
病気が遺伝しているようにみえるのです。
こうした家系の人たちの協力のもと、遺伝子の研究が盛んに行われるようになったのです。
そして、病気の原因とみられる遺伝子が相次いで見つかりました。
最初の大きな発見は、「APP(アミロイド前駆体たんぱく質)」と呼ばれる「アミロイドβ」の元となるたんぱく質を作る遺伝子の変異です。
このたんぱく質は、細胞の膜に埋まったひものような形をしていて、このひもをはさみのような役割をする別のたんぱく質が切ることで、「アミロイドβ」ができます。
アルツハイマー病を発症する家系では、「アミロイドβ」の元となる「APP」に関係する遺伝子にほんのわずかな変異が見られたのです。
その変異があると「アミロイドβ」が固まりやすくなることも分かりました。

この研究に携わったイギリスのロンドン大学のジョン・ハーディー教授は、1990年代のはじめに「アミロイドβ」がアルツハイマー病を引き起こす原因に関係しているという仮説を発表しました。
これが「アミロイドβ仮説」です。
当時はまだ「アミロイドβ」がたまる仕組みや、たまった「アミロイドβ」が脳の神経細胞を壊してしまうメカニズムなどは分かっていませんでしたが、少なくとも「アミロイドβ」は病気を引き起こす原因だとする考えが広がっていったのです。
「アミロイドβ」を減らしたワクチン療法、しかし…

「アミロイドβ」が原因ならば、このたんぱく質を脳から取り除けば、治療できるのではないか。
そうした考えが出てくるのは自然なことです。
ただ、どうやって取り除くのか、これが大きな問題でした。
そうしたなか、アメリカの医療ベンチャーにいたデール・シェンク博士が画期的な方法を考え出します。
シェンク博士は、マウスに「アミロイドβ」そのものを注射し、体内の免疫細胞に敵と認識させることができれば、免疫の力で「アミロイドβ」が排除できるのではないかと考えたのです。
あらかじめ病原性をなくしたウイルスを注射することで免疫力を高めるワクチンとよく似た仕組みの「ワクチン療法」でした。
そして、1999年に国際的な科学雑誌「ネイチャー」に衝撃的な論文を発表します。

「これは、動物モデルにおいてアルツハイマー病理の進行を抑制する臨床的に意義のある治療法の最初の報告である」(ネイチャーに掲載された論文より)
マウスの実験で「アミロイドβ」の蓄積が抑制され、かたまりが消えたと論文で報告したのです。
シェンク博士は、その研究成果をもとに、人での治験を行いましたが、その結果は予想外のものでした。
298例中18例に脳の炎症など重い副作用が出てしまい、死亡する人も出てしまったのです。
「ワクチン療法」の治験は中止となりました。
しかし、この研究はこれで終わりではありませんでした。
治験の参加者を対象にしたその後の研究で、この方法で確かに「アミロイドβ」のかたまりが脳から取り除かれていたことが分かってきたのです。
結果が出ない治療薬開発
重い副作用を避けながらも、脳から「アミロイドβ」を減らすにはどうすればいいのか。
中止となった「ワクチン療法」は、「アミロイドβ」を注射することで、人間の免疫に抗体を作らせるものでした。
しかし、免疫をコントロールするのは簡単ではなく、予想外の反応が起きるおそれがあります。
では、副作用を抑えて、抗体の力だけを使うことはできないのか。

それを可能にする技術が、最近になって急速に発展してきました。
人工的に作り出した抗体を投与する「抗体医薬」と呼ばれる技術です。
ちなみに、人工的に作り出された抗体は、末尾が「-mab」で終わる名前が付けられることが多いのですが、これは「モノクローナル抗体(monoclonal antibody)」を意味しています。
「レカネマブ(Lecanemab)」もその1つです。
世界中の製薬会社は、この「アミロイドβ」の抗体に注目しました。
しかし、その後も最終的な承認までたどりつく薬はありませんでした。
再び予想外の壁が立ちはだかっていたのです。
それは「アミロイドβ」のかたまりを取り除いても、症状の改善や進行を遅らせる効果が確認できないという問題でした。
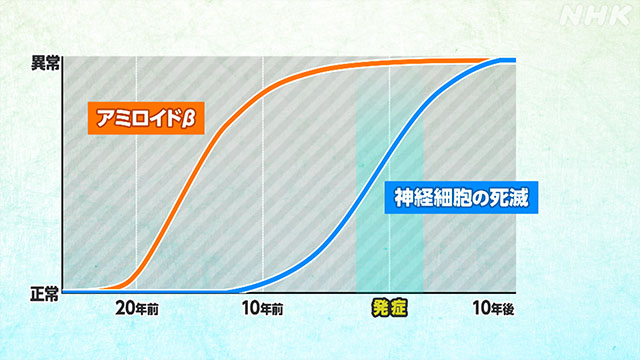
実は、「アミロイドβ」は認知症の症状が現れる20年以上も前から脳に蓄積し始めます。
脳の神経細胞の死滅も発症の10年以上前から始まっているというのです。
アルツハイマー病を発症し、脳に「アミロイドβ」のシミができるころには、すでに病気が進んでしまっているため、薬を使っても遅すぎる可能性があったのです。
新薬開発のきっかけは1通の手紙

こうしたなか、今回の新薬開発につながる重要な研究が北欧のスウェーデンで行われていました。
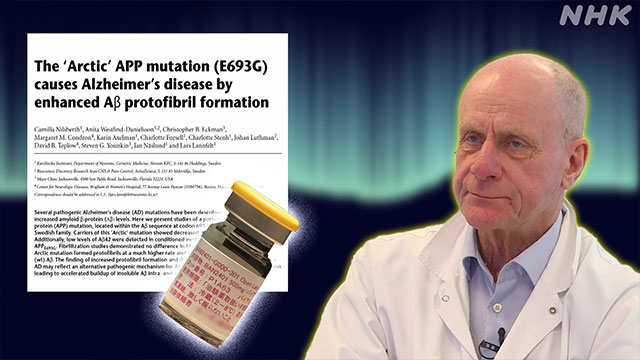
きっかけは、ウプサラ大学の教授だったラーシュ・ランフェルト博士に、北部のウメオという町の医師から1通の手紙が届いたことでした。
この町にアルツハイマー病の患者が多い家族がいるので、調査に興味がないかという内容でした。
ラーシュ・ランフェルト 博士
「現地の医師が手紙をくれたのは、私がアルツハイマー病の遺伝学に取り組んでいることが、スウェーデンで知られていたからだと思います。調査をさせてもらった方たちは親族の多くがアルツハイマー病で亡くなるところを見てきたため、研究が進むようにと、非常に協力的でした」

その家系は50%の確率でアルツハイマー病が遺伝しているようにみえました。
ランフェルト博士は、その家系の人たちに協力してもらい、遺伝子を詳しく調べたところ、特有の遺伝子の変異が見つかったのです。

その変異は、2001年に「北極変異(arctic mutation)」と名付けられ、論文として発表されました。
この変異があると、「アミロイドβ」が非常に固まりやすくなります。
そして、「アミロイドβ」が繊維状のかたまり(=老人斑)になる前の段階の「プロトフィブリル」という物質が脳の中に多くできるのです。
この「プロトフィブリル」には、神経細胞を壊す強い毒性が確認されました。

ランフェルト博士は、「プロトフィブリル」こそがアルツハイマー病の原因となっているのかもしれないと考えました。
そして、日本の製薬会社「エーザイ」と共同で薬の開発に取りかかったのです。
「エーザイ」は、認知症の症状を一時的に緩和する薬として一般的に使われている「ドネペジル(販売名:アリセプト)」を世界で初めて開発した会社で、次の大きな目標として、根本的な治療薬を作ろうとしていました。
そして、12年に及ぶ治験の末、生まれたのが新薬「レカネマブ」でした。
「レカネマブ」のメカニズムと効果は
「アミロイドβ」に結合する「レカネマブ」 動画提供:金沢大学 小野賢二郎 教授
「レカネマブ」は、「アミロイドβ」に集まってその表面に多くとりつきます。
その結果、「アミロイドβ」はかたまりを作ることができなくなってしまい、免疫によって取り除かれるのです。
「レカネマブ」を投与した実験映像では、粒のように見える「アミロイドβ」の周囲に、さらに小さな「レカネマブ」の粒が次々と取り囲む様子が確認できます。
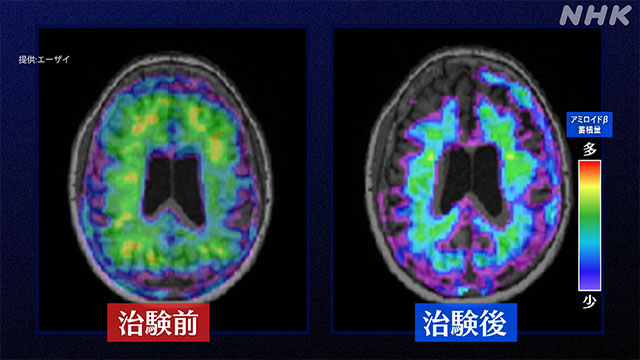
治験の結果として発表されたデータでは、薬を投与した人の脳にある「アミロイドβ」は減少していました。
また、症状についても「レカネマブ」を投与された患者は、「プラセボ」と呼ばれる有効成分が入っていない薬を投与された患者と比べて、1年半後の認知機能の低下がおよそ27%抑えられていたことが分かりました。
製薬会社によりますと、このことから早期の患者がより重い症状のステージに進行するのを2年から3年遅らせることができると推定されるということです。
一方で、副作用について、薬を投与された患者の17.3%で脳の出血が、12.6%で脳の腫れが報告されました。
ほとんどが比較的軽い副作用だったということですが、研究グループは今後も長期的な安全性の確認を行っていくとしています。

今回の成果について、ランフェルト博士は、「レカネマブ」の開発は研究者と病気の長い闘いの歴史の通過点の1つに過ぎないと考えています。
ラーシュ・ランフェルト 博士
「2022年に新薬の効果を示すデータが得られたときには、うれしかった一方で、うまくいくはずだと確信もしていました。長年の多くの人々による科学的な議論があったからこそ、私たちは知識を深め、開発を進めることができました。私は、アルツハイマー病を患っている様々な人に特別なことをしたいと思っていて、もちろん今後も研究を続けていきます。将来的には、ほかの標的の発見や薬の開発など前向きな発展がおそらくあるだろうと確信しています」

研究開発に参加した東京大学の岩坪威教授は、「レカネマブ」の登場によって、アルツハイマー病の治療のあり方自体が変わっていくという見方を示しています。
東京大学 岩坪威 教授
「アルツハイマー病の研究や治療の歴史の中で、大きなターニングポイントとなる出来事だったと思います。病気の原因は複数あると考えられていますが、今回、『アミロイドβ』を取り除く抗体医薬で治療効果が証明されたということは、それが正しい標的の1つであったことを示す結果だと言うことができるはずです。アルツハイマー病の概念が変わりつつある時代に我々は到達したのかと思います」
NEWS UPアルツハイマー病の新治療薬 アメリカで承認 日本では?
ご意見・情報 をお寄せください