科学と文化のいまがわかる
医療

遺伝子治療がひらく未来
2021.09.30
「遺伝子治療」ということばを聞いたことはありますか?
何となく聞いたことがあっても詳しくは知らない、という人も多いのではないでしょうか。
実は、この「遺伝子治療」の技術は、新型コロナウイルスとの闘いからがん治療まで、想像以上に私たちの身近なところまで、影響を与えるようになってきています。
私たちの未来を変える(かもしれない)、知って得する(かもしれない)、遺伝子治療の最新情報をお伝えします。
目の難病を治す 遺伝子治療が現実に
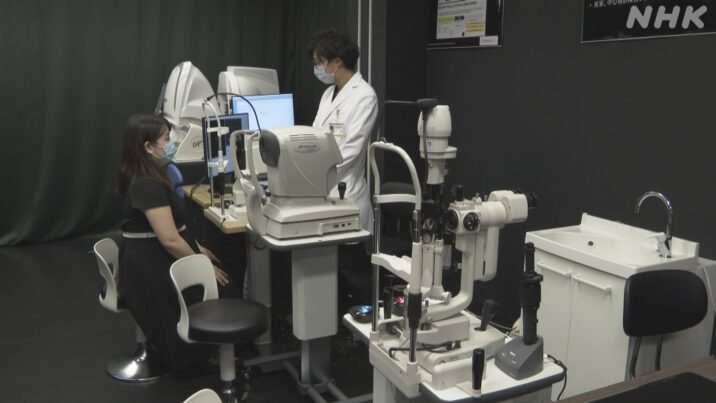
東京・目黒区の国立病院機構東京医療センターにある壁一面が真っ黒に塗られた部屋。
なにやら大がかりな装置が並ぶこの場所で、現在、目の難病の治療を目指してある薬の治験が行われています。
治験の対象となっているのは「遺伝性網膜ジストロフィー」という先天性の目の病気の患者。
遺伝子の一部に異常があることで起こる病気で、原因となる遺伝子はこれまでに300種類以上確認されています。
今回の治験は、このうち「RPE65」という遺伝子に異常がある患者を対象としています。
「RPE65」は光を感じ取るのに欠かせない「ロドプシン」というたんぱく質に関わる遺伝子です。

「ロドプシン」がうまく働かないことで、初めは暗い場所が見えにくくなり、視野が欠けて次第に視力が落ちていきます。進行するとほとんど目が見えなくなることもあります。
幼い頃に発症する病気で、これまで根本的な治療法はありませんでした。
そこで開発されたのが遺伝子治療の薬「ボレチジーン ネパルボベック」です。
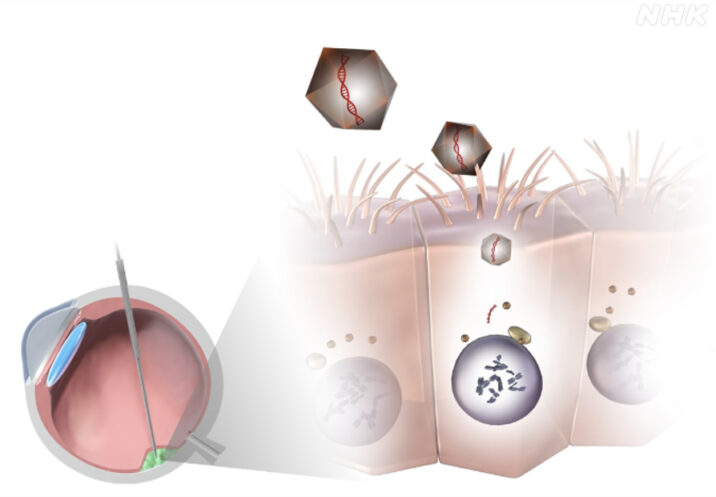
「薬」と書きましたが、中に入っているのは「アデノ随伴ウイルスベクター」です。
人工的に毒性をなくしたウイルスで、遺伝子を運ぶ役割を持つことから、「運び屋」を意味する「ベクター」と呼ばれています。

治療ではこのウイルスベクターの中に正常な「RPE65」遺伝子を組み込み、目の網膜下に直接、注射で投与する手術を行います。
ウイルスベクターは、網膜にある「網膜色素上皮細胞」を選んで正常な遺伝子を送り込みます。
この遺伝子によって「ロドプシン」が働くようになり、病気の治療に結びつけられるというのです。

治療は、症状が進行しきってしまう前に行う必要があり、治験ではこれまでに4歳以上の患者4人が投与を受けたということです。
今後、有効性や安全性について慎重に判断されることになっています。
治験で使われる部屋が真っ黒に塗られていたのは、暗い場所での視力や「ロドプシン」が働いているかどうかを正確に測定するためだったのです。
効果は?安全性は?
遺伝子をウイルスに組み込んで目の中に運ぶ、こう言われると「本当に大丈夫?」と感じる人がいるかもしれません。
しかし、実はこの薬はアメリカやヨーロッパではすでに効果と安全性が確認されたとしてすでに承認されています。薬を開発したアメリカの会社のウェブサイトによりますと、両目に投与した患者のおよそ9割で症状が改善したということです。
国内では、大手製薬会社「ノバルティスファーマ」が治験を実施していて、治験の結果、効果と安全性が確認されれば国に承認を申請するということです。
承認されれば目の病気の遺伝子治療としては国内では初めてとなります。

東京医療センター視覚生理学研究室 藤波芳室長
網膜の遺伝病は長らく、不治の病とされてきましたが、この遺伝子治療の登場は革命的です。
正常な遺伝子を補充することで光を感じやすくなるという非常にシンプルな治療法なので、今回治療の対象とならなかった別の遺伝子が原因の患者に対する治療開発も今後、どんどん進むと見込まれます。
遺伝子治療とは

この目の治験に限らず、最近、「遺伝子治療」は大きな注目を集めています。
アイデアが最初に提唱したのは1970年代、今から50年ほど前です。
カリフォルニア大学サンディエゴ校の助教(当時)だったセオドア・フリードマン博士でした。
フリードマン博士は、ウイルスを患者の体内に正常な遺伝子を届ける運び屋として活用することで、先天的な病気の治療につながる可能性を示しました。
そして、1990年代に入ると、世界で初めて実際に遺伝子を人に投与する研究が始まります。しかし、国内外の研究はいずれも十分な効果が確認されませんでした。
そんな中、2000年になって、フランス・ネッカー小児病院(当時)のアラン・フィッシャー博士のグループが、遺伝子治療を使って「X連鎖重症複合免疫不全症」という病気の症状を劇的に改善することに成功したと発表しました。
遺伝子治療の有用性を確認した大きな成果でした。
ちなみにフリードマン博士、フィッシャー博士は、2015年に「遺伝子治療の概念の提唱とその臨床応用」により日本国際賞を受賞しています。
遺伝子治療の研究は、副作用の問題などで停滞した時期もありましたが、研究は脈々と続けられ、副作用を防ぐ様々な技術も開発されました。
そして2010年ごろには、さまざまな病気で成功例が相次いで発表されるようになり、期待が高まっています。
遺伝子治療の仕組みは?
遺伝子治療は「病気を治療するために遺伝子や遺伝子を導入した細胞をヒトの体内に投与すること」(厚生労働省 遺伝子治療等臨床研究に関する指針)です。
遺伝子は、ヒト(だけではありませんが)の体の設計図で、「たんぱく質」を作り出すための情報です。その情報はDNA(デオキシリボ核酸)を暗号のように組み合わせることで保存されています。
ヒトにはおよそ2万個の遺伝子があるとされていて、これらが決められたタイミングと決められた強さで複雑に働きながら1個の細胞から人間の体を作り上げていきます。
このとき重要な役割を持った遺伝子にわずかでも異常があると、必要なたんぱく質が、作られなくなったり、正常に働かなかったりすることがあります。中には、体の機能に異常が出て、さまざまな症状が出たり、がん細胞が発生したりしてしまう場合があります。これが遺伝子異常で起こる病気です。
こうした病気に対して、正常な遺伝子(「設計図」)を外から入れ、正常なたんぱく質を作り出すことで根本的な治療を目指そうというのが、もともとの遺伝子治療の発想です。
最近の遺伝子治療
ところが、この遺伝子治療、可能性はそれだけにとどまりませんでした。
遺伝子に異常があるかどうかに関係なく、この技術を使えば病気の治療に効果があるたんぱく質を体内で作り出すことができるからです。これも遺伝子治療のカテゴリーに含まれています。

▽例えば、がんの治療です。
日本で2年前に新しいがんの免疫療法として承認された「CAR-T細胞療法」。
人の体内にある免疫細胞のT細胞を患者の体内から取り出します。

がん細胞と結合しやすくなる分子を発現させる遺伝子を入れることで、T細胞ががん細胞を捉える力や攻撃力を高めます。
▽また、同じ年に、承認された遺伝子治療の薬「コラテジェン」は、血液が流れにくくなり、足の一部がえ死することがある「重症虚血肢」の治療薬で、血管を新しく作ることを促すたんぱく質を作り出す遺伝子が含まれています。
これらはいずれも異常な遺伝子に対して正常な遺伝子を補うものではなく、治療に役立つたんぱく質を作り出すという薬で、これも遺伝子治療とされています。
▽もちろん、もともとの意味での遺伝子治療の薬も実用化されています。
2020年、国内でも承認された「ゾルゲンスマ」は、遺伝子の一部が働かないことで全身の筋力が低下する難病「脊髄性筋萎縮症」の治療薬です。正常な遺伝子を「アデノ随伴ウイルスベクター」で体内に運ぶことで、1回投与すれば大きな効果が期待できます。
遺伝子治療の可能性
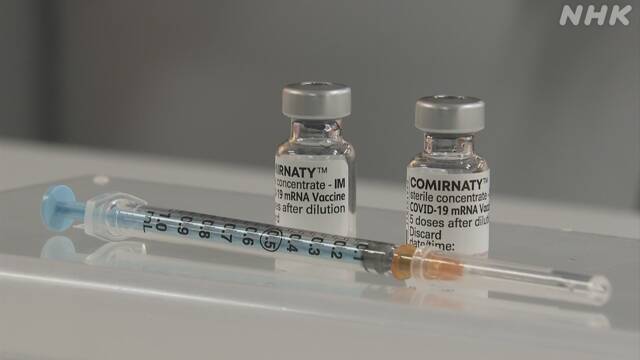
そして、去年(2020年)、私たちのより身近なところにこの遺伝子治療の技術が活用される大きな出来事がありました。
新型コロナウイルスのワクチンです。
世界で多くの人たちが接種を受けたファイザーやモデルナ、それにアストラゼネカなどの新型コロナウイルスのワクチンは、いずれも遺伝子治療の技術を応用したものです。
これらのワクチンには、私たちの免疫がウイルスを攻撃する際の目印となる、ウイルスの「スパイクたんぱく質」の遺伝子が含まれています。
「mRNA」と呼ばれる遺伝情報を含んだ物質を脂肪で包んで投与するファイザーやモデルナのワクチン、ヒトには無害な「アデノウイルス」というウイルスに遺伝情報を組み込んで投与するアストラゼネカのワクチン、それぞれ遺伝子や遺伝情報を体内に入れて働かせる方法は違いますが、もともとは遺伝子治療から派生したものです。
ワクチンは病気の予防のためのもので、治療というイメージから離れますが「遺伝子治療」の技術のさらなる可能性を示したと言えます。
課題も

さまざまな活用法が期待されている遺伝子治療の技術ですが、課題も残されています。
そのひとつが人材の育成です。
遺伝子治療を行う際には、どの遺伝子に異常があるのか見極めて最適な治療法を選ぶ必要があります。
病気の専門家、遺伝子の専門家、そして患者を支えるカウンセラーなどさまざまな分野の専門家が関わることになりますが、国内ではまだ専門的な人材は限られています。
例えば、今回、目の遺伝子治療の治験を行っている国立病院機構東京医療センターの藤波室長によりますと、眼科医療と遺伝医療の両方で学会から認定されている医師の数は全国で20人以下と少なく、このうち網膜の病気を専門としているのは藤波室長を含めて、数人だということです。
もう1つの課題が費用です。
遺伝子治療に使われる治療用の遺伝子や「運び役」となるウイルスを作るには今のところ多くの費用がかかります。
このため治療費が高額になるケースが少なくありません。
例えば、国内で承認されている「ゾルゲンスマ」は価格がおよそ1億6700万円、CARーT細胞療法の「キムリア」はおよそ3300万円とされています。
今回、治験を実施中の網膜の治療薬も、アメリカでは両目の治療であわせて1億円近い価格となっています。
これまでは治すことができなかった病気が治療できることを考えると、「高額すぎる」のかどうかを判断するのは簡単ではありませんが、今後、コストの面でも改善が期待されています。
日本では研究面での課題も
また、研究面でも課題があります。
世界中で研究が進められている遺伝子治療ですが、国内での研究は決して順風満帆ではないと指摘する専門家がいます。長年、遺伝子治療の研究開発に取り組んできた自治医科大学の小澤敬也名誉教授です。

自治医科大学 小澤敬也名誉教授
遺伝子治療の研究・開発が停滞していた時期でも欧米では大学やベンチャー企業が中心になって開発を続けていたが、日本では国の研究費が乏しく、企業も開発に二の足を踏んでいた。
また、若い研究者が少なく基礎研究でも海外と比べて周回遅れになっている状態だ。ここ数年、遺伝子治療が現実的な治療法として確立されつつあり、世界的には大手製薬会社が競ってこの分野に参入するようになっていて、『本格的幕開け』の時代を迎えている。
日本もこの流れに取り残されないよう、今後、国レベルで研究開発や実用化への応用を後押ししていく必要がある。
終わりに
遺伝子治療はかつての不治の病を治してしまう「夢の医療」として現実のものとなってきています。
新型コロナウイルスのパンデミックでは、この技術によって1年足らずの間にワクチンが完成するという、これまでの常識を覆すような成果を上げました。夢のような医療の幕開けが、今まさに始まっているのかもしれません。
ただ、この夢の医療の幕開けは、突然始まったものではなく、研究者や医療者たちの地道な努力の上に成り立っています。
目の遺伝子治療の治験を行っている国立病院機構東京医療センターの藤波室長が話していた「病気の仕組みを理解する努力を重ねれば、いつか治療の道が開ける」ということばが印象的でした。
今、この瞬間も次の「夢の医療」を目指して多くの研究者たちがしのぎを削っているはずです。